干货 | DNA 在琼脂糖凝胶中的迁移速率受哪些因素影响?
跑电泳是分子生物学实验的一项基本技术。而琼脂糖凝胶电泳作为生物学实验中最常用的技术之一,其主要特点有哪些?DNA 在琼脂糖凝胶中的迁移速率又受什么因素影响呢?

琼脂糖作为凝胶电泳常用支持物,其纯度会直接影响DNA的分辨能力及电泳结果的清晰度。
MonTrack™ Agarose琼脂糖是标准熔点琼脂糖,专为常规分离分析而设计,可分离50~15,000 bp范围内的DNA和RNA 片段。
MonTrack™ High Gel Strength Agarose与高纯度琼脂糖相比,分离范围相同,硬度提高33%,制胶厚度低至3~4mm时仍能够保持凝胶的完整性。




高纯度琼脂糖(ME00101) /高硬度琼脂糖(ME00201)
jnh官网知道,琼脂糖凝胶电泳是常用的用于分离、鉴定 DNA、RNA 的方法,这种
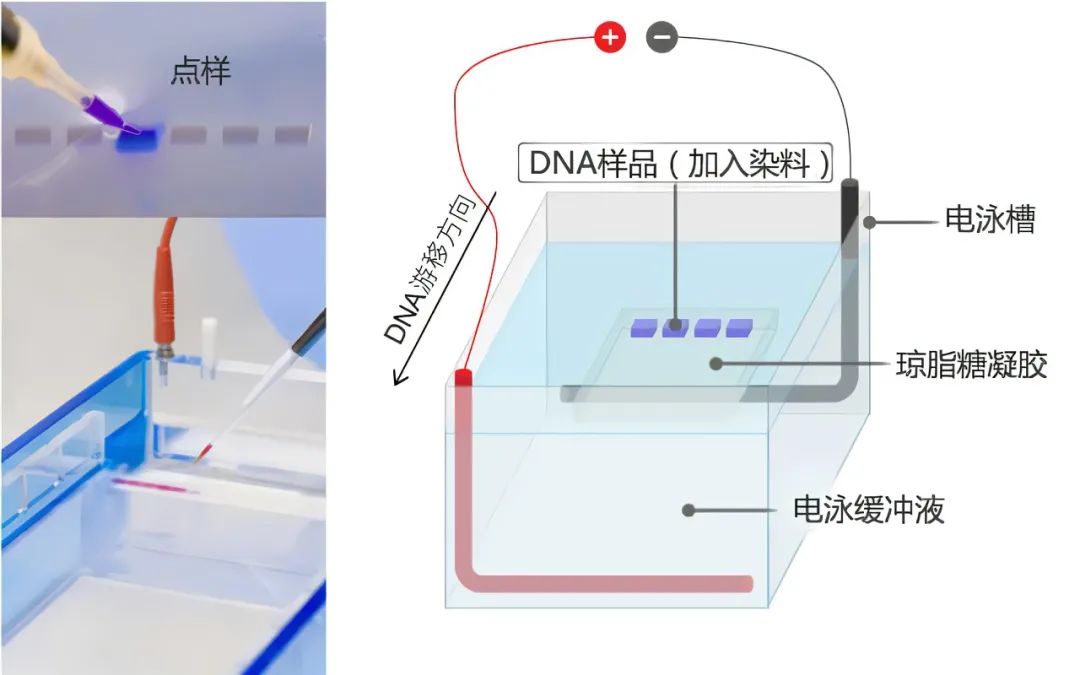
DNA 在琼脂糖凝胶中的迁移速率:
影响因素有哪些?
通过凝胶的电流
根据欧姆定律 V = IR 式中, V 是电压; I 是电流(单位安培); R 是电阻(单位欧姆)。因为用于电泳的缓冲液通常是微碱性的(pH 7.8~8.0),通过凝胶的 DNA 分子携带负电荷,并以所施加的电流形成的速率向阳极迁移。
DNA 分子的大小
双链 DNA 分子在凝胶基质迁移的速率与其碱基对数的常用对数( log10 )成反比(Helling et al. 1974)。大分子 DNA 摩擦阻力大,通过凝胶孔径的效率低于小分子 DNA ,因此迁移速率慢。
琼脂糖浓度
琼脂糖凝胶是由氢键和疏水作用聚合在一起的多孔胶体。在电流的作用下,DNA 线性分子通过一系列孔径泳动,这些孔径的有效直径取决于凝胶中琼脂糖的浓度(如下图所示)。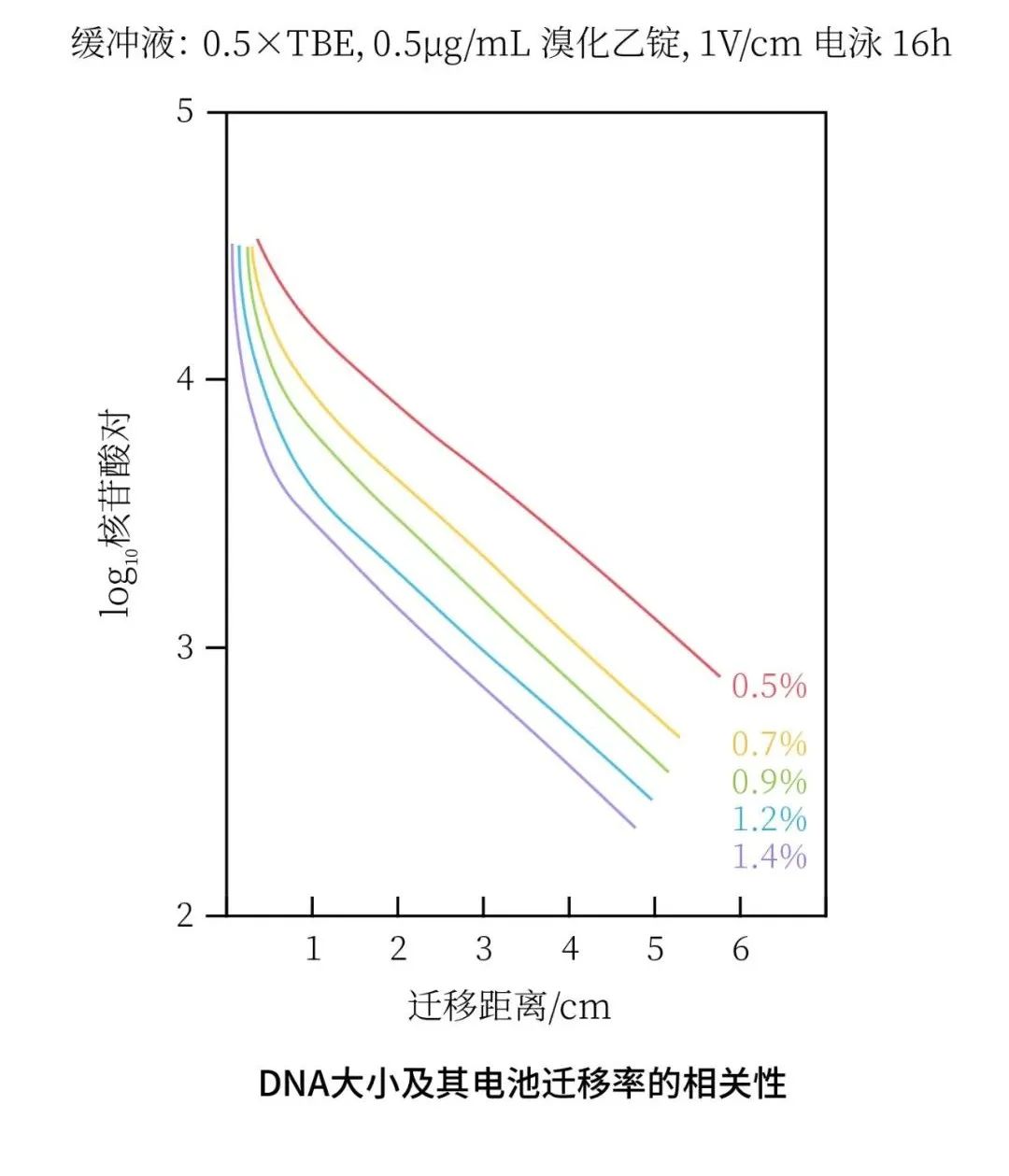
式中, μ0 是 DNA 自由电泳迁移率, Kr 是阻滞系数,是一个与凝胶性质、迁移分子大小和形状相关的常数。
DNA 的构象
超螺旋环状(Ⅰ型)、切口环状(Ⅱ 型)和线性(Ⅲ 型) DNA 在琼脂糖凝胶中迁移速率不同(Thorne 1996,1967)。
凝胶和电泳缓冲液中的染料
染料插入双链 DNA 造成其负电荷减少,而刚性和长度增加。因此,线状 DNA-染料复合物在凝胶中的迁移率约降低15%( Sharp et al.1975)。
施加电压
低电压时,线状 DNA 片段迁移率与所用的电压成正比。但是,电场强度升高时,高分子质量 DNA 片段的迁移率不成比例增加。所以,当电压增大时,琼脂糖凝胶分离的有效范围反而减小。要获得大于2kb DNA 片段的良好分辨率,则所用电压不应高于5~8 V/cm。
琼脂糖种类
常见的琼脂糖主要有两种:标准琼脂糖和低熔点琼脂糖( Kirkpatrick 1990),正在研制的第三种是熔点和凝点介于上述二者之间的琼脂糖,它兼有两者的特性。
电泳缓冲液
DNA 的泳动受电泳缓冲液的组成和离子强度的影响。缺乏离子(如用水替代电冰槽及凝胶中的缓冲液)则电导率降至很低。DNA 迁移极慢,或者完全不动。高离子强度时,如错用了10×电泳缓冲液,电导率升高,即使应用适中的电压也会产生大量的热量。最严重时凝胶会熔化,DNA 会变性。
有几种缓冲液适用于天然双链 DNA 的电泳,它们包括 Tris -乙酸盐和 EDTA 缓冲液(pH 8.0, TAE ,也称为 E 缓冲液)、Tris -硼酸盐和 EDTA 电泳缓冲液( TBE )或 Tris -磷酸盐和 EDTA 电泳缓冲液(TPE ),工作浓度约50mmol/ L ,pH 7.5~7.8。各种电泳缓冲液通常配制成浓溶液于温室存放(见每种实验方案后的配方)。这些缓冲液都非常有效,选择哪一种使用主要看个人工作习惯。
三者之中 TAE 的缓冲容量最低,如长时间电泳会被消耗。此时凝胶的阳极一侧将发生酸性化,凝胶中向阳极迁移的溴酚蓝的颜色呈现从蓝紫色到黄色的变化。该颜色变化从pH 4.6开始,到pH 3.0终止。定期更换缓冲液或调换两个电极池的缓冲液可以防止 TAE 的消耗。TBE 和 TPE 比 TAE 花费稍贵些,但是它们有高得多的缓冲容量。
双链线状 DNA 片段在 TAE 中比在 TBE 或 TPE 中迁移速率快10%左右。对于高分子质量 DNA ,TAE 的分辨率高于 TBE 或 TPE ;对于低分子质量 DNA ,TAE 要差些。此差别也许解释下述现象:高度复杂混合物中的 DNA 片段,如哺乳类动物 DNA ,用 TAE 电泳可有较高分辨率。因此,用于分析复杂基因组的 Southern 印迹( Southern blot )均用 TAE 作为电泳缓冲液制备凝胶和电泳。超螺旋 DNA 在 TAE 中的电泳分辨率要好于 TBE 。



